![]()
1.1 体細胞分裂と減数分裂
1.2 減数分裂と体細胞分裂の細胞周期進行
1.3 減数分裂における染色体分配異常
1.4 酵母の減数分裂における微小管の重要性
1.5 ほ乳類の減数分裂の異常と不妊の関係を調べる
1.1 体細胞分裂と減数分裂
細胞分裂には2つの様式があります。そのうちのひとつ「体細胞分裂」は,我々の身体が形成されるために幾度となく繰り返されてきた分裂様式です。もとの1個の細胞(母細胞)から, それと同一の細胞(娘細胞)を2個生み出すもので, 細胞が増殖するために用いられる分裂様式です。
これに対して「減数分裂」は, 配偶子を作り出すために必須の分裂様式です。ここでは, もとの1個の細胞と同じものを作ることが目的ではありません。一般的な細胞は両親由来の2組の染色体(遺伝情報)を持っているため2倍体と呼ばれますが,配偶子では1組しかもっておらず,1倍体と呼ばれます。イメージとしては1倍体の配偶子どうし(精子と卵)が受精することで1+1=2倍体の新しい受精卵が作り出され,生命誕生に至ると考えることができます。したがって配偶子は1組のみの染色体をもつ必要があり,すなわち減数分裂では2倍体の細胞から1倍体の細胞を作る,染色体の倍数性を減らすのが最大の目的となります。決して,2倍体の母細胞と同じものを作り増殖するのではありません。
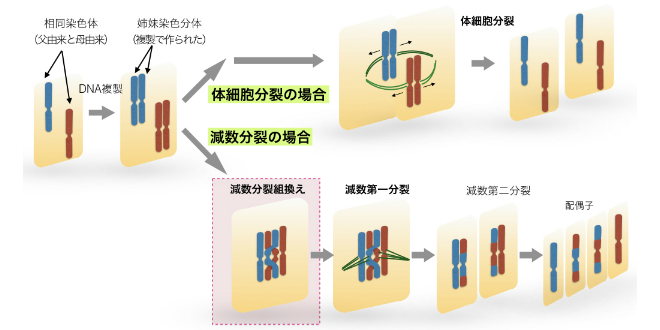
図1-1 体細胞分裂と減数分裂における染色体の倍数性の違いはどのようにして作られるのか
模式化した体細胞分裂と減数分裂の違い。1個の細胞における相同染色体(赤と青)がDNA複製を経て体細胞分裂を起こす場合(上)と減数分裂を起こす場合(下)。減数分裂では相同染色体どうしが対合して減数分裂組換えを起こす。その後,第一分裂と第二分裂の2回の分裂を連続しておこなうことで配偶子を形成する。
1.2 減数分裂と体細胞分裂の細胞周期進行
これら2種類の分裂様式は, 酵母からヒトに至るまで, 真核細胞生物において幅広く保存されています。このような秩序だった2種類の細胞分裂は, どのように制御されることで正しく実行されているのでしょうか。我々は特に2つの分裂様式の違いに注目して, 研究を進めています。
(1) 体細胞分裂と減数分裂では何が違うのか
(2) その違いはどのような遺伝子の働きによって作り出されるのか
(3) その違いは何のために作られたものなのか
これらの3項目を念頭に置いて細胞を見てみると, 顕微鏡でしか見えない小さな細胞であっても, 厳密に制御された分子システムが存在していて, そのおかげで, 細胞が適切な時期に適切な様式の細胞分裂をおこなうことが保証されている, その神秘に気づくことでしょう。
これまで,減数分裂のメカニズムを研究しやすい分裂酵母を用いて,体細胞分裂と減数分裂の違いについて調べてきました(この研究の多くは当時在籍していた東大大学院理学系研究科生物化学専攻にておこなったものです)。
分裂酵母の場合は,細胞の培養環境によって細胞の運命が決まります。栄養が豊富な条件下では体細胞分裂終期を繰り返して増殖します(図1-2および 図1-3)。しかし,栄養源が少ない状況におかれると,細胞周期がG1期で停止し,その後,減数分裂に向かうべき運命が決まります。これは一種の分化であり,性分化と呼ばれます。G1期停止後,2倍体の細胞はDNA合成と減数分裂組換えを経て減数第一分裂,その後,減数第二分裂をおこないます。2回の分裂を経て染色体の倍数性が「1倍体」になったあと,胞子(配偶子)としての形態を作ります。
酵母は1倍体で体細胞分裂をおこない増殖することが可能ですが,その場合,栄養源が枯渇してもただちに減数分裂を開始することは通常ありません。1倍体の細胞の場合は,まず接合して2倍体の細胞を作ります。一般には減数分裂を行うための必要条件として「2倍体であること」が求められますが,これは減数分裂の本来の目的が染色体の倍数性を減らす(2倍体細胞から1倍体細胞を作る)ことにあると考えれば当然のことです。
体細胞分裂と減数分裂の細胞周期の違いは,まず分かりやすいのは,
(1)減数分裂には「減数分裂組換え」が存在すること(図1-1参照)
(2)減数分裂には「減数第一分裂」と「減数第二分裂」の2回の核分裂があり,
その間にはDNA合成が起きないこと(図1-2, 図1-3参照)
が挙げられます。
(1)の減数分裂組換えは,相同染色体どうしが物理的に結合する(対合=ペアをつくる)ことで,対合した染色体の一部が入れ替わる現象(遺伝子乗り換え)がみられます。(2)は,体細胞分裂であれば分裂期と分裂期の間には必ずS期(DNA合成期)があるのに対して,減数分裂では第一分裂と第二分裂の間にS期がないという差のことです。
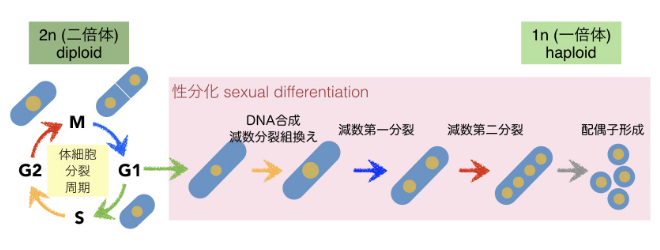
図1-2 一般的な体細胞分裂と減数分裂の細胞周期進行
二倍体の細胞はG1期で停止し,性分化過程に突入する。減数第一分裂の後,DNA合成がない状態で減数第二分裂をおこない,その後配偶子を形成する。
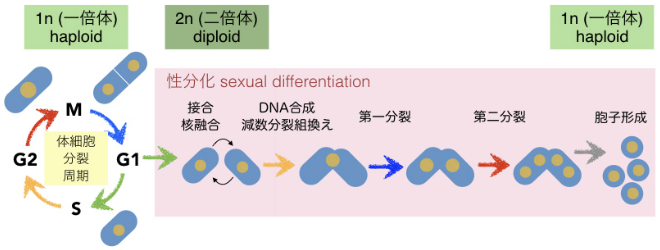
図1-3 分裂酵母における体細胞分裂と減数分裂の細胞周期進行
分裂酵母は一倍体で生育可能であり,これが栄養源飢餓の環境におかれると接合して二倍体細胞となる。その後減数分裂(第一分裂・第二分裂)をおこない,胞子を形成する。
我々はさらに減数分裂においてのみ見られる現象を探して,その分子メカニズムを解明していきました。例えば,
(A) 減数分裂では中心体に相当するSPB(紡錘体の極)を構成する因子が大規模に再編成されること
(B) 減数第二分裂では,紡錘体微小管のなかでも極と極とつなぐ微小管は必要ないこと
(減数第二分裂では,微小管への依存度が低い機構で染色体分配が可能)
(C) 減数第三分裂はなぜ起きないのか? ある特定の変異体では異常な減数第三分裂が起きること
などを発見し,その現象の起きる意義やメカニズムを解析してきました。
Related Publication:
(A)について:Ohta et al. (2012) Molecular Biology of the Cell
(B)について:Akera et al. (2012) Nature Communications
(C)について:Aoi et al. (2013) EMBO reports
1.3 減数分裂における染色体分配異常
体細胞分裂における染色体分配の異常は,細胞のがん化と関連することが指摘されています。これに対して, 減数分裂において染色体分配異常が生じると, 流産・不妊・ダウン症候群などのトリソミー型先天性染色体異常の原因となると考えられています。ヒトのダウン症候群は21番染色体が本来2本であるべきところ3本になっている異数体(トリソミー)のことです。3本存在するに至った原因はいくつか考えられますが, 一例を挙げると精子または卵子を形成する減数分裂の過程で染色体分配の異常が起き,21番染色体を2本含む配偶子が形成され, それが受精したため(1+2=3となり)3本になった可能性です。
1.4 酵母の減数分裂における微小管の重要性
では,減数分裂で染色体分配異常が起きる原因は何でしょうか。体細胞分裂と減数分裂とで染色体分配異常が生じる原因は同じであることもありますが,減数分裂特有の原因もあるはずです。我々は,減数分裂というシステム自体に, 染色体分配異常を起こしやすい何らかのリスクがあるのではないかと仮定し,そのリスクの正体を追究するために分裂酵母(減数分裂研究の優れたモデル生物)を使って研究を行っています。
分裂酵母を用いた我々の研究の結果,減数分裂においては微小管が特別な働きを担うことで染色体分配異常が起きるリスクを低減させていることが分かりました。
我々はこの研究を始めるにあたり,染色体分配異常を起こしやすくなるリスクとは何かをまず検討し,体細胞分裂にはない減数分裂に特有の現象である「減数分裂組換え」の際にリスクが生じるのではないかと考えました。
「染色体が核の中にどのように位置しているか」が重要な問題だと考えるに至りました。通常,分裂酵母が増殖する細胞周期(体細胞分裂終期)では,間期において染色体の動原体(キネトコア)部位が紡錘体の極(SPBまたは中心体と呼ばれる)の近くに集まって存在しています(図1-4 上段)。このような染色体の配置はRabl配向と呼ばれ,安全な染色体分配をおこなうために都合が良いとされています。細胞が分裂期に突入した際に紡錘体微小管は紡錘体の極(SPB)から形成されてきますが,形成されてすぐに近くに集合している動原体を捕捉結合することが可能であり,その結果,微小管は染色体を取り損ねることなく安全な染色体分配を遂行することができるからです。
しかし,減数分裂においては,まったく異なる位置に染色体が配置されています。減数分裂の前段階として染色体が「減数分裂組換え」をおこないますが,この時点では染色体の末端であるテロメアが紡錘体の極(SPB)の近くに集められ,かわりに動原体は極から遠く離れた位置に置かれてしまいます(図1-4 下段)。この染色体の配置はブーケ配向(Bouquet orientation)と呼ばれ,減数分裂組換えを促進するためには必須の染色体状態であることが知られます。しかし,その後の染色体分配のことを考えると,動原体が極から遠く離れた状態では紡錘体微小管が捉えにくくなり,染色体を取り損ねるリスクが生じるだろうと我々は考えました。
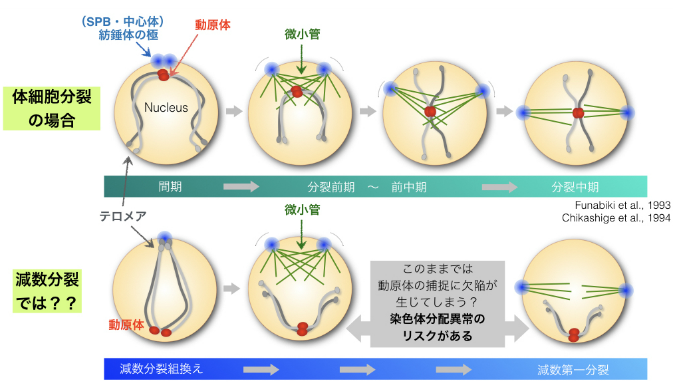
図1-4 減数分裂では核内の染色体配置が体細胞分裂とは異なることが減数分裂失敗のリスクとなるかもしれない
体細胞分裂周期の場合,間期の頃からすでに染色体の動原体が紡錘体極(SPB)の周辺に集合している。これに対して減数分裂では,動原体はSPBから遠く離れた位置にあるため,そのままではリスクの高い染色体分配になってしまうことが想像される。
では細胞はこのリスクをどうやって低減させているのでしょうか。我々は生きた細胞の中の様々な構造をGFP(緑)RFP(赤)CFP(青)の3色の蛍光タンパク質で可視化した状態で,傾向顕微鏡を用いてライブセル・イメージングをおこなう実験系を確立していたので(Sato, Toya and Toda, 2010, Methods in Molecular Biology),これを駆使して減数分裂組換えから減数分裂(減数第一分裂)に突入する時期の細胞に焦点を当てて観察しました。その結果,組換え期を終えた頃,紡錘体極から,紡錘体とは形状の異なる放射状の長い微小管が形成され,核内の遠くに離れた動原体を捕まえて紡錘体極(SPB)の近くまで染色体を連れ戻すことを発見しました(図1-5 ①)。
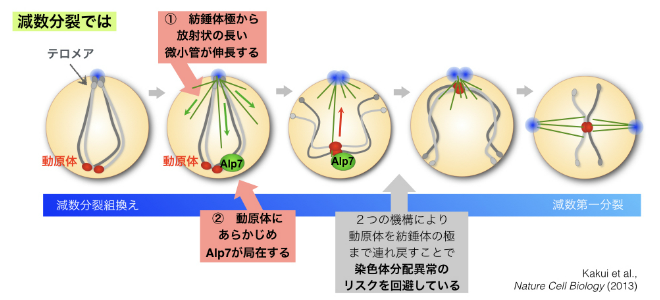
図1-5 減数分裂の染色体配置問題は,微小管とその結合タンパク質Alp7によって解消される
細胞はこのようなリスクを解消するために,2つの機構を備えている。①SPBから放射状の微小管が形成されて,遠くに離れた動原体をつかまえてSPBまでたぐり寄せる ②微小管結合タンパク質であるAlp7をあらかじめ動原体に配置しておき,微小管との相互作用を促進する。
すなわち,動原体が遠く離れたままでは分配異常の脅威となるため,これを改善するために微小管が形成され,遠くの動原体を極近くまで連れ戻すことで,体細胞分裂におけるRabl配向と同様の配置にして,安全な染色体分配を可能にしていると考えられます。
それでは,この放射状微小管による染色体の「連れ戻し」は本当に重要なことなのでしょうか。我々は微小管が極度に不安定化する変異体を用いてこの時期の細胞を観察したところ,微小管が形成されずに動原体の位置が遠くに放置されたままとなり,その後の減数第一分裂で染色体分配異常を引き起こすことが分かりました。したがって,放射状微小管は減数分裂の遂行に必須の役割を持つといえます。
細胞が減数分裂を安全に行うための「秘策」はこれだけではありませんでした。放射状の微小管が動原体をうまく捕まえて連れ戻すために,微小管結合タンパク質であるAlp7(ヒトTACC3タンパク質に相当する因子)があらかじめ動原体に局在して微小管がやってくるのを待ち構えていることが分かりました(図1-5 ②)。Alp7(TACC3)は微小管結合タンパク質ですから,微小管から離れて染色体の動原体に存在するのは異例のことであり,体細胞分裂の時には見られない,減数分裂ならではの「秘策」だといえます。
減数分裂のこの時期には,分裂期リン酸化酵素のひとつであるPoloキナーゼ(Plo1)もまた動原体に位置することが知られていました。このPoloキナーゼがAlp7をリン酸化することでAlp7を動原体にあらかじめ待機させることが分かりました。
ここでもやはり,Alp7が動原体に局在することは本当に意味のあることなのかが問題です。我々はPoloキナーゼからリン酸化を受けないようなAlp7の変異体を作製しました。この変異体で微小管が伸長してきた際に,動原体は微小管と一旦は結合できるのですが,すぐに動原体が微小管から滑り落ちてしまうことが分かりました。すなわち,Alp7は,あらかじめ動原体に待機し,放射状の微小管がやってきたときに微小管と動原体の結合を促進する役割があることが実証されました。
これらの2つの「秘策」のおかげで,染色体分配異常のリスクが高い減数分裂でも安全な染色体分配を遂行できているといえます。本研究の業績は,Nature Cell Biologyに掲載され,いくつかの新聞紙面やウェブサイトでも紹介されました(早稲田大学広報のウェブサイト)。
Related Publication:
Kakui et al. (2013) Nature Cell Biology
Kakui and Sato (2016) Chromosoma [Review]
Sato et al. (2009) Methods in Molecular Biology
Ohta et al. (2012) Molecular Biology of the Cell
1.5 ほ乳類の減数分裂の異常と不妊の関係を調べる
昨今, 妊娠出産の高齢化にともない,卵子の経年劣化が社会的にも大きな関心を寄せています。一般的なほ乳類の卵形成では,胎児の頃から思春期に至るまで減数分裂が減数第一分裂の前期で長期停止しており,その後分裂を再開して排卵され受精に至るという特徴があります。この長期停止が経年劣化に繋がるという概念は卵子に特有のものです。ただし, 精子形成であれ卵形成であれ, 染色体分配に異常があれば配偶子の染色体の本数は異常になるため,不妊の原因は精子にも卵子にもあり得ます。
いずれにしても, ヒトの卵形成には,酵母の減数分裂とは異なる別種のリスクが存在すると考えられます。特に,経年した卵子にはどのような問題が起きているのかをさぐり,将来的に不妊治療への応用・貢献を目指します。そこで現在,不妊治療クリニックと連携して医療・不妊治療の現状を把握しながら,発生工学を専門とする麻布大学獣医学部 伊藤潤哉先生と連携しておこなう「生殖医理工ネットワーク」を立ち上げ,ほ乳類の減数分裂における染色体分配異常のリスクがどこにあるのかを調べています。
