![]()
3.1 細胞周期の各時期における微小管の形態
3.2 分裂酵母における核輸送と微小管形成の連携
3.3 ヒト培養細胞における微小管再編成のメカニズム
3.1 細胞周期の各時期における微小管の形態
一般的な真核細胞では,細胞周期の間期(分裂期ではない時期)にあるときに微小管は細胞質に網目状に形成されます。ところが細胞周期がG2期から分裂期(M期)に突入する際に,微小管の形態は大きく変化し,間期の網目状の構造が消失し,かわりに紡錘体構造へと再編成されます(図3-1)。間期の網目状の微小管は,細胞内の物質輸送のレールとしての役割があり,分裂期の紡錘体を構成する微小管は染色体を分配するために必須の役割を担います。このように微小管は細胞周期の時期に応じて形態を適切に変化させて多様な機能を発揮しているといえます。微小管の構造や機能は教科書などでも広く知られていますが,細胞質微小管が紡錘体に再編成される際の分子機構については不明な点が多いのが現状です。
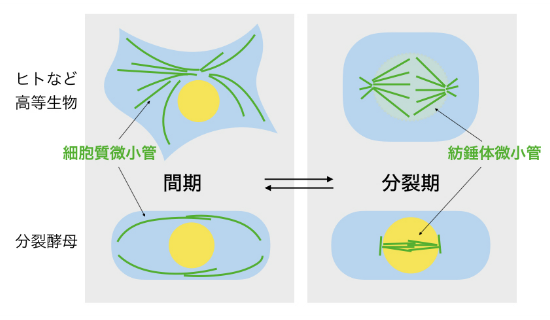
図3-1 細胞周期の間期と分裂期では微小管の形態が大きく異なる
間期には細胞質に網目状の微小管が形成されるが,分裂期にはこれが消失し,紡錘体へと再編成される。我々はその再編成の分子メカニズムを研究対象としている。
3.2 分裂酵母における核輸送と微小管形成の連携
そこで我々は,第一に分裂酵母をモデル系としてとらえ,微小管再編成の分子メカニズムを追究しています。酵母においては,分裂期でも核膜が消失しないため(closed mitosisと呼ばれる),紡錘体は核内に形成されます(図3-2)。すなわち,間期は細胞質に,分裂期は核内に微小管が形成されるように,微小管を形成するための時間と場所が細胞内で厳密にコントロールされているといえます。我々はここに着目し,分裂期開始とともに微小管を紡錘体へと再編成するためには,核–細胞質間輸送と密接に連携しているはずだと考えました。
既にアフリカツメガエルの生化学実験などの成果から,核–細胞質間輸送を統括するマスター制御因子であるRanタンパク質(低分子量GTPase)が微小管形成を促進する働きがあることが分かっていました。
Ranは細胞質にはGDP結合型の状態(Ran-GDP)で存在し,核内ではGTP結合型(Ran-GTP)で存在します(図3-2)。例えば核内輸送において,Ranは核内に運ばれてきたタンパク質(積み荷)を核内に降ろす(unloading)機能を担います。しかしながら,高等生物の細胞では分裂期には核膜が消失するため,核–細胞質間輸送という概念自体がなくなり,その意味ではRanの機能が発揮できなくなるといえます(図3-2)。そのような分裂期に,なぜRanは別の役割として微小管形成を促進するのでしょうか。その意義は不明とされてきました。
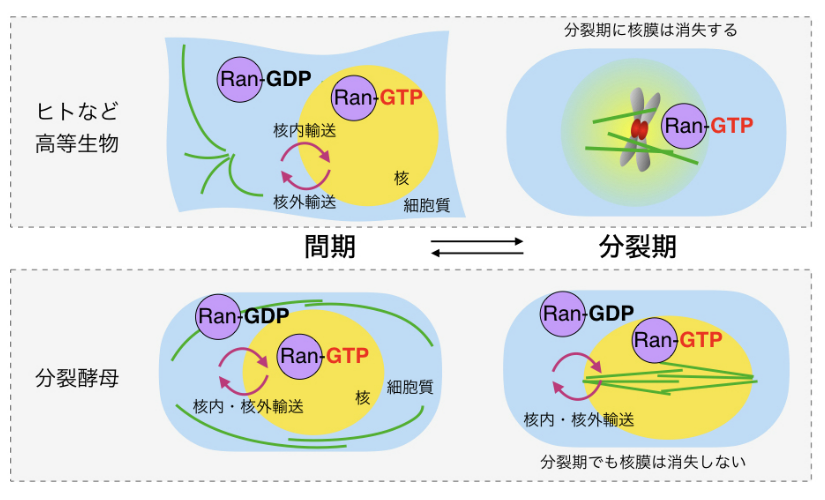
図3-2 核輸送と微小管形成には関連がある
核・細胞質間の輸送を制御するのはRanであり,間期細胞の核内にはGTP結合型Ran(Ran-GTP)が多く存在し,細胞質内にはGDP結合型Ran(Ran-GDP)が局在する。高等生物の細胞では分裂期に核膜が消失するがRan-GTPは微小管形成を誘導する。酵母では分裂期にも核膜が消失しないので分裂期にも核輸送は起きている。
我々は,酵母では分裂期でも核膜が消失しないため,分裂期の開始とともにRanが微小管形成を誘導する因子を核内に蓄積させることで,核内での紡錘体形成を促進すると考えました(図3-2)。酵母ではRanが微小管形成を促進する必要があったといえます。このような酵母においてRanの役割がうまれ,これが起源となり,種の進化とともに核膜が消失するようになったあとでもRanの微小管促進機能がそのまま利用されていると想像できます。
では,Ranは分裂酵母でどのような標的タンパク質を核内に蓄積させることで分裂期の紡錘体形成を誘導するのでしょうか。我々は分裂期にのみ核内に蓄積する微小管結合タンパク質であるAlp7(ヒトTACCオーソログ)がRanの標的タンパク質として機能し,分裂期の開始とともに核内で微小管の形成を促進することを突き止めました(図3-3)。
Related Publication:
Sato and Toda (2007) Nature
Sato et al. (2004) Molecular Biology of the Cell
Sato et al. (2003) Nature Cell Biology
佐藤政充,戸谷美夏,登田隆(2008)蛋白質核酸酵素
では,Alp7はなぜ分裂期にのみ核内に蓄積するのでしょうか。我々の研究の結果,Alp7はサイクリン依存性キナーゼ(CDK1)によってリン酸化を受けることを見いだし,このリン酸化によって核輸送受容体Importin αとの結合が強まり,核輸送が加速するとの結論を得ました。細胞内では,このようにして分裂期のみAlp7を核内に蓄積させ,紡錘体を形成しているといえます(図3-3)。
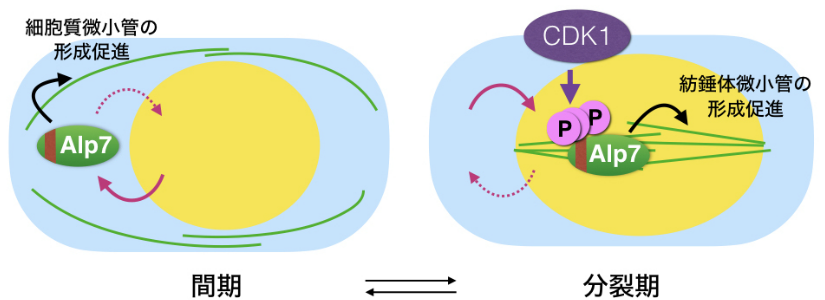
図3-3 Alp7はCDK1によるリン酸化を受けて分裂期にのみ核に蓄積する
(左)間期の分裂酵母細胞では微小管結合タンパク質Alp7は核と細胞質間を行き来しているが,核に移行しても核外に排出されて主に細胞質に局在し,その結果,細胞質微小管の形成を促進する。(右)G2期から分裂期に突入する際に,Alp7はサイクリン依存性キナーゼCDK1によるリン酸化を受けて核に蓄積する。このように微小管の再編成にはAlp7の局在変化が重要な役割を果たす。
Related Publication:
Okada et al. (2014) Molecular Biology of the Cell
Okada and Sato (2015) Cells [Review]
Sato et al. (2009) EMBO reports
このようにしてAlp7の局在が微小管形成に大きな影響を与えることが分かりましたが,まだまだ不明な点が残ります。特に,Alp7はどのようにして微小管の形成を促進するのかはまったく謎です。現在はAlp7タンパク質が微小管を生み出すメカニカルな作用機序を追究しているところです。
これに関連して我々は,細胞内での微小管形成に重要な働きを担うγ-チューブリン複合体にも注目して研究を進めています。γ-チューブリン複合体はγ-チューブリンおよびその結合タンパク質により構成され,酵母からヒトまで真核生物にひろく保存されています。γ-チューブリン複合体は,微小管の重合核を形成して微小管の形成基点となることで,13本のプロトフィラメントからなるチューブ状の微小管を作るのに大きく貢献します(図3-4)。分裂酵母が紡錘体を形成するためにはγ-チューブリン複合体が紡錘体の極である中心体(SPB)に存在することが必要であり,そのために必須の因子であるPcp1はAlp7と相互作用する可能性を指摘してきました。その他にも,γ-チューブリン複合体が相互作用する因子であり,紡錘体を制御する因子としてMsd1などがあり,関連を調べています。
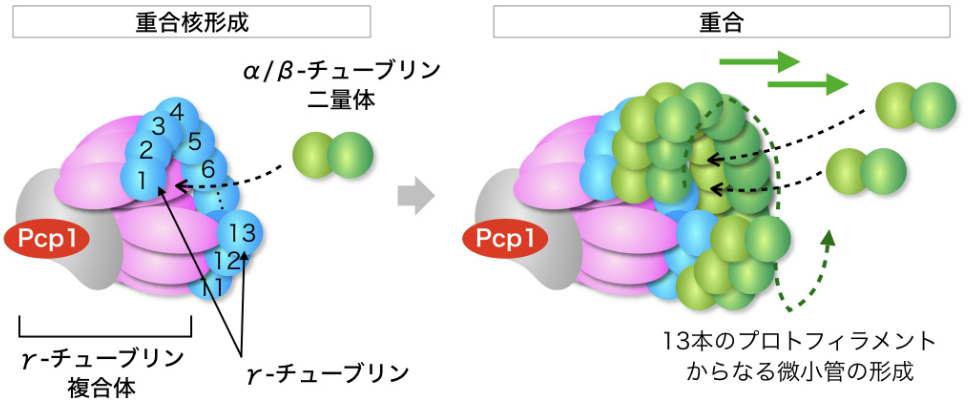
図3-4 γ-チューブリン複合体から微小管が形成されるメカニズム
γ-チューブリン複合体には,γ-チューブリンの他にGCP2, GCP3などの構成タンパク質が含まれる。これらが13分子のγ-チューブリンで1周するようなリング状の構造を作り(左),γ-チューブリンのとなりにα/β-チューブリン2量体が次々と結合することで重合核が形成され,その後はα/β-チューブリン2量体どうしの会合による重合反応へと引き継がれる(右)。
Related Publication:
Fong, Sato and Toda (2010) EMBO Journal
Tang et al. (2014) FEBS Letters
Toya, Sato et al. (2007) Nature Cell Biology
3.3 ヒト培養細胞における微小管再編成のメカニズム
このように分裂酵母において,微小管を再編成する分子メカニズムを明らかにしてきたため,次に我々はヒト培養細胞において同様のシステムが作用しているのかを追究しています。Alp7のヒトにおけるオーソログはTACC3(Transforming Acidic Coiled-Coil)タンパク質であり,これが重要である可能性は容易に指摘できます。しかし,高等生物の紡錘体形成の仕組みは酵母よりも複雑だと考えられるため,別の因子も含めて究明を続ける必要があります。
