![]()
4.1 CENP-Aによる動原体の形成メカニズムの解明
4.2 細胞周期の停止・再稼働の遺伝子発現プロファイリング
4.3 分裂酵母 非コードRNA(ncRNA)の解析
4.1 CENP-Aによる動原体の形成メカニズムの解明
動原体の形成には,ヒストンH3バリアントであるCENP-Aタンパク質がセントロメア領域に結合することが必須であることが知られています。しかし,CENP-Aが染色体のセントロメアのところだけに呼び込まれ,分裂をどれだけ繰り返してもそれがエピジェネティックに維持されていくメカニズムには不明な点が多く残ります。本プロジェクトでは,CENP-Aがどのように制御されて動原体を作っていくのかに迫ります(図4-1)。
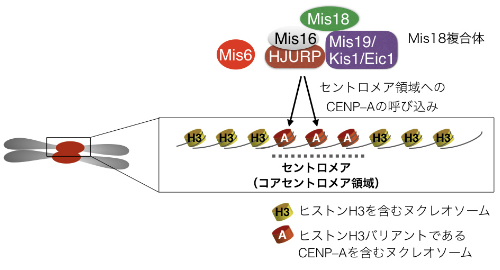
図4-1 セントロメア領域にはCENP-Aを含むヌクレオソームが集合し,これが動原体を形成するための基盤となる
Mis18複合体などの因子は,ヒストンH3バリアントであるCENP-Aを含むヌクレオソームをセントロメア領域に呼び込む。その結果,様々な動原体タンパク質が集合し,複雑な動原体構造が形成される。
我々は,紡錘体微小管の形成に重要な役割を担う新規因子を発見するために,大規模な遺伝学的ビジュアルスクリーニングをおこない,紡錘体微小管の中央部分が弱くなる変異体をいくつか単離しました。このなかのひとつの変異体について原因遺伝子を追求した結果,新規の遺伝子(kis1と命名)であることが分かりました。その後,これは他のグループが発見したMis19/Eic1と同一の遺伝子であり,Mis18複合体の構成因子であることが分かりました。Mis18複合体はCENP-Aの局在に必須の因子群であり,酵母からヒトまで保存された機能を担います。
そのMis18複合体の機能ですが,Mis18複合体はヒストンH3のセントロメア特異的バリアントであるCENP-Aタンパク質をセントロメアに呼び込む機能があることが知られています。kis1変異体ではMis18が機能できないためCENP-Aのセントロメアへの結合が著しく低下することが分かりました。Kis1/Mis19/Eic1はMis18複合体の新しく発見された構成因子であるといえます。
しかし興味深いことに,kis1変異体でKis1の機能停止を誘導した場合,CENP-Aは比較的速やかに失われるものの,直ちに動原体タンパク質すべてが散逸するのではなく,ほとんどの動原体タンパク質はまだ動原体に存在し続けることが分かりました(図4-2)。動原体が新規に形成されるにはCENP-Aが重要だとしても,動原体の全体的な構造が維持されるためにはCENP-Aは必須ではないといえます。
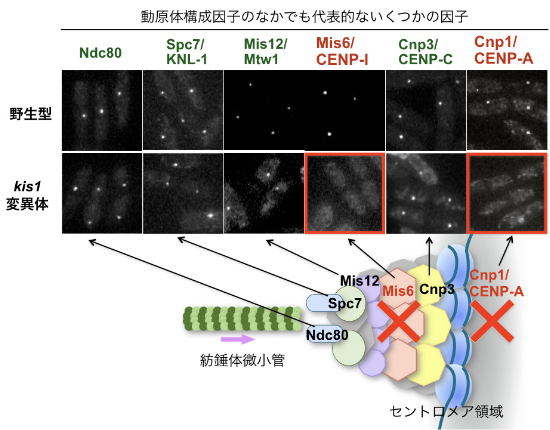
図4-2 kis1変異体ではCENP-AおよびMis6の局在が異常になるが,それ以外の動原体タンパク質の局在は影響を受けない
野生型細胞とkis1温度感受性変異体の細胞において,いくつかの代表的な動原体構成因子の細胞内局在を調べた。これらの因子は細胞内で正しくセントロメア領域に局在するとドット(点)状の顕微鏡像が観察される。高温(36˚C)で4〜6時間培養した場合,kis1変異体では図のようにMis6およびCENP-A (Cnp1)の動原体の局在がみられなくなった。これに対して,それ以外の動原体タンパク質(Ndc80, Spc7, Mis12, Cnp3)の局在はこの時点では影響を受けておらず,野生型と同様の局在を示した。(注)Mis6 (CENP-I)はKis1と同様に,CENP-Aのセントロメア領域への局在に必要であることが既に知られている(Takahashi et al. Science, 2000)。
このように,kis1変異体でCENP-Aが存在しない場合でもしばらくは動原体タンパク質が存在し続けます。しかしながら我々の解析結果から,紡錘体微小管はそのようなCENP-A抜きの動原体を正しく結合することができないことが分かりました。このことは,これまでの知見とは少し異なり,微小管が動原体を捕捉するためにはNdc80などの因子だけではなく,CENP-Aもまた貢献している可能性を示唆するものです。そこで現在は,CENP-Aがどのように微小管と動原体の結合を促進するのか,これまでとは違う分子メカニズムについて調べています。
そもそも,kis1変異体は紡錘体微小管の維持ができない変異体として単離していたものです。このことは,微小管は染色体の動原体部位と結合することでさらに安定化されるというメカニズムがあることも発見しました(図4-3)。これらの研究成果はPLoS ONEに掲載されました。
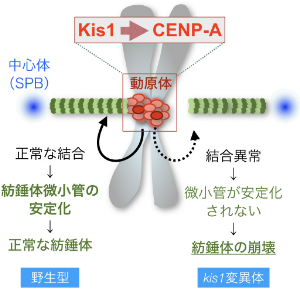
図4-3 紡錘体が安定化するメカニズムのモデル
Kis1を含むMis18複合体の働きによりCENP-Aを含むヌクレオソームがセントロメア領域に局在化でき,その結果,動原体と微小管の結合が促進される。結合が起きると微小管の安定化が起きるが,kis1変異体などでこの結合に異常が生じると微小管は安定化されない。そのためkis1変異体では紡錘体が崩壊したと考えられる。
最初は紡錘体微小管に異常を示す変異体の解析から始めたCENP-Aの研究ですが,我々は現在,どのようにしてCENP-Aがセントロメアに呼び込まれるのかに焦点を当てて研究を展開しています。
Related Publication:
Hirai et al. (2014) PLoS ONE
4.2 細胞周期の停止・再稼働の遺伝子発現プロファイリング
細胞の寿命がどのように決まるのかも細胞生物学分野に残された大きな難問のひとつです。細胞は分裂していない静止期において,長い時間「生存」を保つことができます。細胞はその後,再び分裂サイクルに戻ることもできます(図4-4)。このような細胞周期の静止・再稼働はどのような遺伝子によってコントロールされるのでしょうか? 分裂していない静止期には遺伝子の発現すなわち転写システムはオフになっていて,細胞周期の再稼働とともに転写サイクルが発動するのでしょうか。あるいは静止期でも転写などの細胞活動は稼働し続けているのでしょうか。そのような状態で細胞の長期生存を可能にするのはどのような維持機構が働いているのでしょうか。未だ解決されてない多くの課題があります。
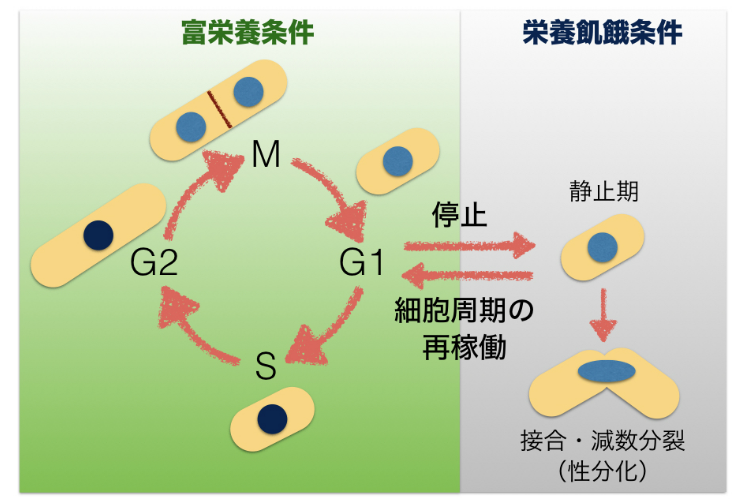
図4-4 栄養状態によって細胞周期の静止または再稼働が決まる
分裂酵母細胞が細胞周期をまわして増殖するか, それとも静止するかは, 細胞をとりまく環境中の栄養源の有無によって決まります。静止期では細胞の長期生存が可能だとされます。栄養源飢餓の状態で2つの性別の細胞が共存すると,それらの細胞は接合・減数分裂という性分化プロセスを開始し, 配偶子を作ります。
本研究では,細胞周期の開始における遺伝子発現の変動を解析することで,細胞周期の始動のメカニズムと,遺伝子発現における転写サイクルのメカニズムに迫ることができると考えました。そこで,そのような細胞を用いて転写プロファイル解析をおこなうことで,細胞の運命決定と遺伝子発現制御の関連を調べています。
4.3 分裂酵母 非コードRNA(ncRNA)の解析
真核細胞の染色体上に存在する遺伝子のなかには,タンパク質をコードしない非コードRNA(ノンコーディングRNA,ncRNA)の遺伝子が多数存在することが明らかになっています。これらのncRNAの機能は大部分が明らかになっておらず,本研究ではその解明を目指しています。バイオインフォマティクスの手法を導入し,ncRNAの網羅的な機能解析を目指して研究をはじめています。
