![]()
2.1 細胞から組織へ
2.2 上皮細胞に特徴的な微小管編成の成り立ちとその役割
2.1 細胞から組織へ
我々の体は数多くの細胞から構成されていることは既に述べたとおりです。これらの細胞は発生過程で適切に分化することで, それぞれ別の役割を担う細胞へと運命決定がなされていきます。すなわち,細胞は細胞分裂と細胞分化を適切におこなった結果, 特定の役割を担うひとまとまりの「組織」として生体内で機能します。組織を大まかに分類すると, 上皮組織・筋組織・神経組織・結合組織の4種類に分けられます。上皮組織は,たとえば体の表面を覆う細胞層や,あるいは内臓などの器官の内面を覆う細胞層(腸であれば,食物の消化物が通っていく内腔の表面の細胞層)などをさします。
歴史的には,微小管の機能や制御の分子メカニズムは主に単細胞生物(酵母など)や高等生物の培養細胞を用いた研究から明らかになってきました。酵母における研究の例はProject 1やProject 3を参照してください。また,体の組織から樹立された様々な培養細胞株においては, 由来する細胞種の性質を保持するかのように(線維芽細胞由来, 上皮由来, 神経細胞由来, 血球細胞由来), 細胞内で微小管の編成が異なることが知られています。このことは,分化した様々な細胞はそれぞれが適切な機能を発揮するために, 微小管の編成を適材適所で制御している可能性を示唆しています。
重要なことに,実際の生体内では細胞は単一で存在するのではなく,細胞が多数集合して形成された組織として存在し,細胞が相互に連携して機能します。たとえば,体内の組織を構成する細胞は,生体内で生育するのと実験用の培養皿で培養されるのとは異なる環境で育つため,それぞれ異なる形態を作ります。上皮細胞株は, 培養皿上では扁平な形ですが, 体内では明らかな高さをもち, 隣どうしの細胞が密に接着した状態で存在します。従って,その組織において生命現象がどのように制御されるのか,あるいは様々な病気の原因がどこにあるのかを調べるためには,単一の細胞を用いた研究では理解が及ばないこともあります。
しかしながら,生体内で実際に組織を構成している細胞のなかで微小管がどのように編成されているのか, また, 微小管の編成が組織の機能にどのように貢献しているのかについては, いまだよくわかっていません。そこで本研究では,マウスをモデル生物として, 哺乳類のさまざまな組織を構成する細胞における微小管編成の詳細とその分子機構の解明をめざします。これらの知見を統合することで,個体レベルで微小管の編成がどのような役割を持つのかを明らかにしたいと考えます。
2.2 上皮細胞に特徴的な微小管編成の成り立ちとその役割
我々のグループを含む近年の研究では, 上皮組織が正しく形成されるために微小管が重要な役割を担うことが分かってきました。そこで我々は,これまでの細胞における細胞骨格研究の成果を足掛かりに,組織における微小管の役割と疾患との関連について研究を進めています。
上皮細胞は, 胃・腸や肺・腎臓など多くの臓器を構成する主要な細胞であり, 酵素やホルモンの分泌・栄養分の吸収・外界とのバリアなど, 生理学的に重要な役割を果たしています。このような役割を果たすために必須の構造的特徴として, 上皮細胞は, 外気や液体にさらされている「頂端面」と結合組織に接着する「基底面」という極性をもちます(図2-1)。一般的な真核細胞の間期(分裂していない時期)には微小管は細胞質に網目状に形成されます(図3-1を参照)が, 極性をもつ上皮細胞においては, 微小管の一端(マイナス端)が頂端面に繋ぎとめられ, もういっぽうの+端(プラス端)を基底面に向けて, 頂端面—基底面をつなぐように, 幾本もの糸が整然と垂れ下がっている簾のような形状を示します(図2-1)。このような上皮細胞に特徴的な微小管編成は1980年代後半には発見されていましたが, この配向・編成を決定づける因子や分子機構, その役割については長い間不明のままでした。
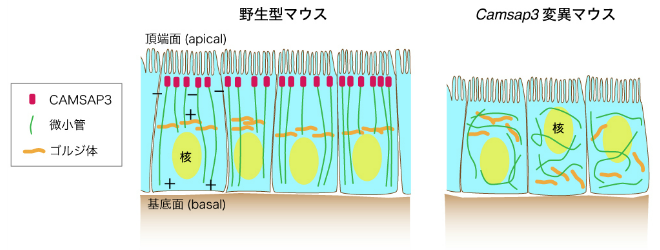
図2-1 小腸上皮細胞にみられる特徴的な微小管の配向性はCAMSAP3により作られる
野生型マウスおよびCamsap3変異マウスの小腸上皮組織における上皮細胞の断面図。野生型では頂端面から基底面に向けて微小管が配向性を持って整列している。これは頂端面に局在するCAMSAP3タンパク質が微小管のマイナス端を繋ぎ止めることによる。Camsap3変異マウスではこのような微小管の整列は乱れ,細胞小器官の配置も異常になる。
当研究室の戸谷らは2016年に, 小腸の上皮細胞に着目して, 微小管の配向を決定づけている分子が, 微小管マイナス端結合因子CAMSAP3であることを明らかにしました(こちらも参照 : 理化学研究所プレスリリース)。
Camsap3の変異マウスとCaco-2細胞(大腸がん由来の培養細胞株)を用いた実験から, 次の2つのことが分かりました。
① CAMSAP3が腸上皮細胞の頂端部に局在して, 微小管の端を繋ぎ止めていること
② CAMSAP3の働きがなくなると, 微小管の端が頂端面から細胞内に脱落して, 細胞質での
微小管配向が大きく乱れ, それにともなって, 核やゴルジ体などの細胞小器官の細胞内での
配置も乱されること
すなわち,CAMSAP3は腸上皮細胞の頂端部において微小管を繋ぎ止めることで配向性を作り出し,これによって,細胞内に存在する様々な細胞小器官の配置を決めていることが分かりました。これらの成果は,米科学誌 Proc. Natl. Acad. Sci. USA に掲載されるとともに,RIKEN NEWS,米国細胞生物学会ASCB ウェブサイト,および国際的な研究者による論文評価システムF1000primeでとりあげられました。
小腸では,大人になったのちも陰窩(いんか)と呼ばれる柔毛の底部において, 常に新しい細胞が生まれます。古くなった腸細胞は柔毛の先端からはがれ落ちて, 新陳代謝することが知られています(図2-2)。新しい細胞は, 陰窩にある幹細胞が分裂することよって生じるため, 細胞分裂時に形成される紡錘体微小管が, 分裂後に特徴的な配向をもった微小管へとどのように再編成されていくのか,きわめて興味深い点です。腸の組織や,腸組織から分離した幹細胞,また上皮培養細胞株の立体培養などの実験系を複合的に用いることで, 上皮細胞における微小管制御の分子機構を明らかにし, 特徴的な微小管編成の生理的な役割を調べたいと考えています。これらの研究は, 理化学研究所多細胞システム形成研究センター(理研CDB)の竹市雅俊先生との共同研究で進めています
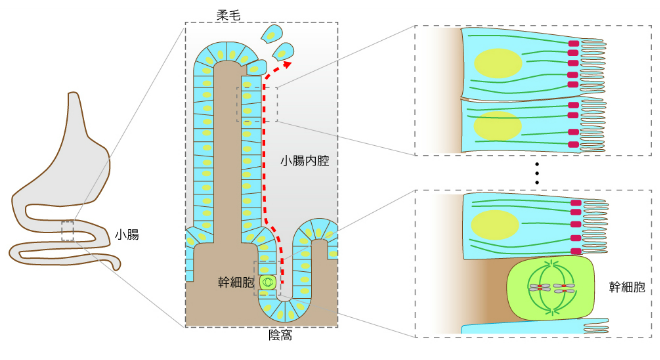
図2-2 小腸上皮組織において幹細胞から作られた上皮細胞は柔毛方向へ送られて新陳代謝が起きる
小腸の腸管内面には,陰窩(いんか)と柔毛が多数見られる。腸の陰窩(いんか)に位置する幹細胞が分裂して生みだされた腸上皮細胞は,陰窩から柔毛先端部に向けて押し出されるかたちで移動し,最終的には先端部から剥がれ落ちて除去される。幹細胞では微小管が紡錘体をつくり染色体を分配し, 細胞分裂を起こす。分裂により生じた上皮細胞は特有の微小管配向性を示すと考えられる。なお,本図では簡略化のため,吸収上皮細胞・幹細胞以外の細胞の描画は省略してある。
興味深いことに,大部分のがん(悪性腫瘍)は上皮組織に形成されることが知られています。大腸がんの発症に関わるタンパク質として,微小管やその制御因子と結合するAPC(adenomatous polyposis coli)タンパク質が同定されていること,さらに, がん治療には微小管重合阻害剤が用いられていることから考えて, 上皮における微小管研究の医学的重要性はこれからさらに高くなると思われます。
Related Publication:
Toya et al. (2016) Proc. Natl. Acad. Sci. USA
Toya and Takeichi (2016) Cell Struct. Function [Review]
